الرابطة التكافؤية : عبارة عن زوج من الالكترونات يربط بين ذرتين تكون نتيجة مساهمة كلِ من الذرتين بالكترون واحد من مستوى التكافؤ .
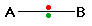
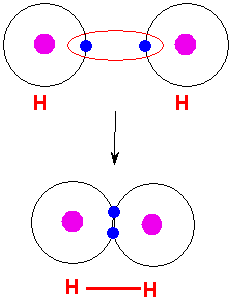

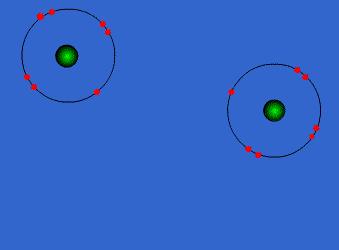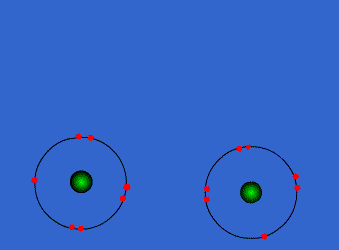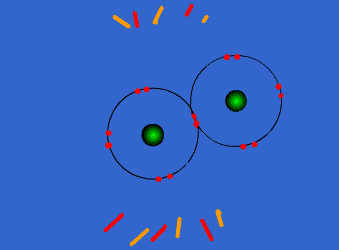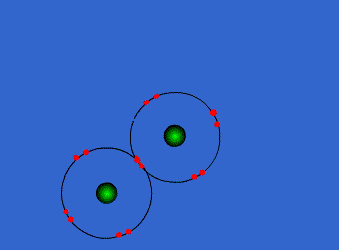
ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


تراكيب لويس
يمكن تمثيل جزيئات المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن
طريق ما يعرف باسم تركيب لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض
الذرات وبعض الجزيئات التساهمية :
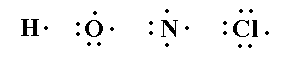
الأشكال الهندسية للجزيئات التساهمية
كما هو معروف فإن الجزيئات التساهمية عبارة عن جزيئات مستقلة تتألف من ذرة
مركزية وذرة أو أكثر طرفية ويوجد حول الذرة المركزية عدد من الأزواج
الالكترونية الرابطة أو ( الرابطة وغير الرابطة ) . ونظراً لأن هذه الأزواج
الالكترونية تتألف من الكترونات سالبة متشابهة في الشحنة فالمتوقع أن يكون
هناك تنافر بينها ، هذا التنافر بين الأزواج الالكترونية الموجودة حول
الذرة المركزية في الجزيء التساهمي يجبرالجزيء التساهمي على اتخاذ شكل
هندسي في الفراغ يحدده عدد هذه الأزواج الالكترونية . ويتحدد مقدار الزوايا
بين هذه الروابط على نوعية الشكل الهندسي الفراغي الذي يتخذه الجزيء وعلى
عدد الأزواج الالكترونية الحرة الموجودة بالجزيء.
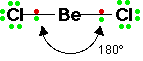
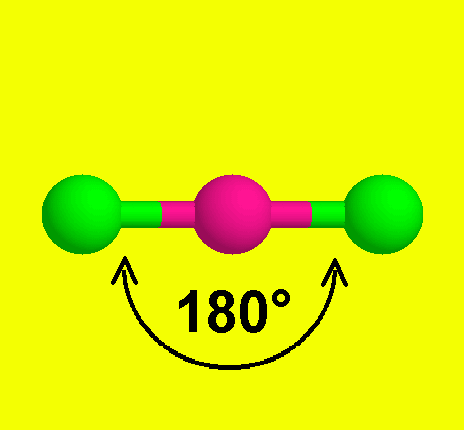
* الشكل الخطي ومثاله كلوريد البريليوم BeCl2
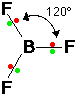
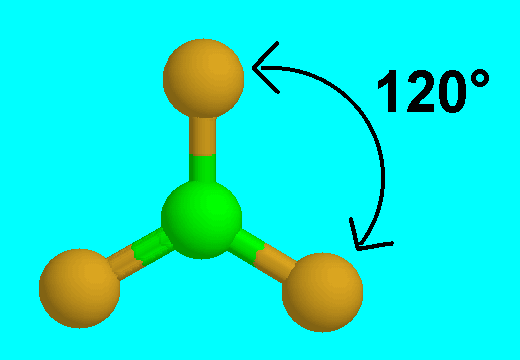
* المثلث متساوي الأضلاع ومثاله فلوريد البورون BF3
* الهرم الرباعي السطوح ومثاله مايلي :
1- الميثان CH4
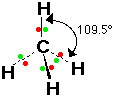

ومثله أيون الأمونيوم +NH4
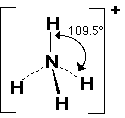
2- النشادر NH3
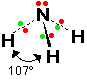

الماء H2O


يلاحظ في شكل الهرم الرباعي السطوح أن وجود أزواج الكترونية حرة في الجزيء
يؤدي إلى صغر الزوايا بين الروابط وذلك لأن التنافر بين زوج رابط وزوج حر
أكبر من التنافر بين زوج رابط وزوج رابط .
فيلاحظ أن الزاوية في النشادر صغرت عن الميثان وأصبحت تساوي 107 درجة والسبب وجود زوج الكتروني حر على ذرة النيتروجين المركزية .
كما أن وجود زوجين غير رابطين ( حرين ) يؤدي إلى المزيد من التنافر وصغر
الرابطة فالزاوية في الماء 104.5 درجة وهي أصغر من مثيلتها في كل من
الميثان والنشادر والسبب وجود زوجين حرين على ذرة الأكسجين في الماء .




ويمكن أن يكون بين ذرتين رابطة تساهمية واحدة أو اثنتان أو ثلاث روابط .


تراكيب لويس
يمكن تمثيل جزيئات المركبات التساهمية وتوضيح كيفية تكون الروابط فيها عن
طريق ما يعرف باسم تركيب لويس ، وفيما يلي سنتعرف على تركيب لويس لبعض
الذرات وبعض الجزيئات التساهمية :
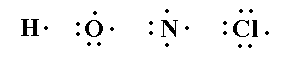
الأشكال الهندسية للجزيئات التساهمية
كما هو معروف فإن الجزيئات التساهمية عبارة عن جزيئات مستقلة تتألف من ذرة
مركزية وذرة أو أكثر طرفية ويوجد حول الذرة المركزية عدد من الأزواج
الالكترونية الرابطة أو ( الرابطة وغير الرابطة ) . ونظراً لأن هذه الأزواج
الالكترونية تتألف من الكترونات سالبة متشابهة في الشحنة فالمتوقع أن يكون
هناك تنافر بينها ، هذا التنافر بين الأزواج الالكترونية الموجودة حول
الذرة المركزية في الجزيء التساهمي يجبرالجزيء التساهمي على اتخاذ شكل
هندسي في الفراغ يحدده عدد هذه الأزواج الالكترونية . ويتحدد مقدار الزوايا
بين هذه الروابط على نوعية الشكل الهندسي الفراغي الذي يتخذه الجزيء وعلى
عدد الأزواج الالكترونية الحرة الموجودة بالجزيء.
* الشكل الخطي ومثاله كلوريد البريليوم BeCl2

| إضغط هنا لرؤية الصورة بحجمها الطبيعي. |

* المثلث متساوي الأضلاع ومثاله فلوريد البورون BF3

| إضغط هنا لرؤية الصورة بحجمها الطبيعي. |

* الهرم الرباعي السطوح ومثاله مايلي :
1- الميثان CH4


ومثله أيون الأمونيوم +NH4

2- النشادر NH3


الماء H2O


يلاحظ في شكل الهرم الرباعي السطوح أن وجود أزواج الكترونية حرة في الجزيء
يؤدي إلى صغر الزوايا بين الروابط وذلك لأن التنافر بين زوج رابط وزوج حر
أكبر من التنافر بين زوج رابط وزوج رابط .
فيلاحظ أن الزاوية في النشادر صغرت عن الميثان وأصبحت تساوي 107 درجة والسبب وجود زوج الكتروني حر على ذرة النيتروجين المركزية .
كما أن وجود زوجين غير رابطين ( حرين ) يؤدي إلى المزيد من التنافر وصغر
الرابطة فالزاوية في الماء 104.5 درجة وهي أصغر من مثيلتها في كل من
الميثان والنشادر والسبب وجود زوجين حرين على ذرة الأكسجين في الماء .




